Hyhy :D wkwk
ak pnya blog bru loh :D
http://miputri-apaajaboleh.blogspot.com :D
Tpi di stu blum ad apa* :D
Lgi males ngepost :D Oh ia :D
Gw uda lma g ngepost nih :D
Liat cerita gw ia di blog satu.a ;)
Jangan lupa di follow jga iah :D
Byebye
My story :p wkwk Naui iyagi :p wkwk
06.06.2010 :) lovelove 14.08.1998 :) It has been the birth of a daughter that is me ^^ wkwk
Story and story
Senin, 06 Desember 2010
Jumat, 12 November 2010
Kamis, 11 November 2010
Keamanan
Asam asetat pekat bersifat korosif dan karena itu harus digunakan dengan penuh hati-hati. Asam asetat dapat menyebabkan luka bakar, kerusakan mata permanen, serta iritasi pada membran mukosa. Luka bakar atau lepuhan bisa jadi tidak terlihat hingga beberapa jam setelah kontak. Sarung tangan latex tidak melindungi dari asam asetat, sehingga dalam menangani senyawa ini perlu digunakan sarung tangan berbahan karet nitril. Asam asetat pekat juga dapat terbakar di laboratorium, namun dengan sulit. Ia menjadi mudah terbakar jika suhu ruang melebihi 39 °C (102 °F), dan dapat membentuk campuran yang mudah meledak di udara (ambang ledakan: 5.4%-16%).
Larutan asam asetat dengan konsentrasi lebih dari 25% harus ditangani di sungkup asap (fume hood) karena uapnya yang korosif dan berbau. Asam asetat encer, seperti pada cuka, tidak berbahaya. Namun konsumsi asam asetat yang lebih pekat adalah berbahaya bagi manusia maupun hewan. Hal itu dapat menyebabkan kerusakan pada sistem pencernaan, dan perubahan yang mematikan pada keasaman darah.
| Konsentrasi berdasar berat | Molaritas | Klasifikasi | Frase-R |
|---|---|---|---|
| 10%–25% | 1.67–4.16 mol/L | Iritan (Xi) | R36/38 |
| 25%–90% | 4.16–14.99 mol/L | Korosif (C) | R34 |
| >90% | >14.99 mol/L | Korosif (C) | R10, R35 |
Sifat-sifat kimia
- Keasaman

- Dimer siklis
- Sebagai Pelarut
- Reaksi-reaksi kimia
Aluminium merupakan logam yang tahan terhadap korosi karena dapat membentuk lapisan aluminium oksida yang melindungi permukaannya. Karena itu, biasanya asam asetat diangkut dengan tangki-tangki aluminium.
Asam asetat mengalami reaksi-reaksi asam karboksilat, misalnya menghasilkan garam asetat bila bereaksi dengan alkali, menghasilkan logam etanoat bila bereaksi dengan logam, dan menghasilkan logam etanoat, air dan karbondioksida bila bereaksi dengan garam karbonat atau bikarbonat. Reaksi organik yang paling terkenal dari asam asetat adalah pembentukan etanol melalui reduksi, pembentukan turunan asam karboksilat seperti asetil klorida atau anhidrida asetat melalui substitusi nukleofilik. Anhidrida asetat dibentuk melalui kondensasi dua molekul asam asetat. Ester dari asam asetat dapat diperoleh melalui reaksi esterifikasi Fischer, dan juga pembentukan amida. Pada suhu 440 °C, asam asetat terurai menjadi metana dan karbon dioksida, atau ketena dan air.
- Deteksi
Asam trikloroasetat


 Asam trikloroasetat
Asam trikloroasetat Informasi
Nama sistematis = Asam trikloroetanoat
Nama umum = Asam trikloroasetat
Rumus molekulCCl3COOH
Massa molar163.4 g/mol
Densitas dan fase1.63 g/cm3, padatanTitik lebur57 °CTitik didih196 °CPenampilanpadatan putihKeasaman (pKa)0.77
Asam trikloroasetat (nama sistematis: asam trikloroetanoat) adalah analog dari asam asetat, dengan ketiga atom hidrogen dari gugus metil digantikan oleh atom-atom klorin. Senyawa ini merupakan asam yang cukup kuat (pKa = 0.77, lebih kuat dari disosiasi kedua asam sulfat). Senyawa ini dibuat melalui reaksi klorin dengan asam asetat bersama katalis yang cocok.
Senyawa ini banyak digunakan dalam bidang biokimia, untuk pengendapan makromolekul seperti protein, DNA dan RNA. Garam natriumnya digunakan sebagai pembasmi rumput liar. Larutan yang mengandung asam trikloroasetat digunakan untuk penghapus tato dan pengobatan kutil, termasuk kutil kelamin (aman digunakan selama kehamilan). Garam-garam dari asam trikloroasetat disebut trikloroasetat. Reduksi sebagian dari asam trikloroasetat menghasilkan asam dikloroasetat, merupakan suatu obat aktif yang berpotensi dapat menyembuhkan penyakit kanker.
Struktur asam amino
Struktur asam amino secara umum adalah satu atom C yang mengikat empat gugus: gugus amina (NH2), gugus karboksil (COOH), atom hidrogen (H), dan satu gugus sisa (R, dari residue) atau disebut juga gugus atau rantai samping yang membedakan satu asam amino dengan asam amino lainnya.Atom C pusat tersebut dinamai atom Cα ("C-alfa") sesuai dengan penamaan senyawa bergugus karboksil, yaitu atom C yang berikatan langsung dengan gugus karboksil. Oleh karena gugus amina juga terikat pada atom Cα ini, senyawa tersebut merupakan asam α-amino.
Asam amino biasanya diklasifikasikan berdasarkan sifat kimia rantai samping tersebut menjadi empat kelompok. Rantai samping dapat membuat asam amino bersifat asam lemah, basa lemah, hidrofilik jika polar, dan hidrofobik jika nonpolar.
Isomerisme pada asam amino
Karena atom C pusat mengikat empat gugus yang berbeda, maka asam amino—kecuali glisina—memiliki isomer optik: l dan d. Cara sederhana untuk mengidentifikasi isomeri ini dari gambaran dua dimensi adalah dengan "mendorong" atom H ke belakang pembaca (menjauhi pembaca). Jika searah putaran jarum jam (putaran ke kanan) terjadi urutan karboksil-residu-amina maka ini adalah tipe d. Jika urutan ini terjadi dengan arah putaran berlawanan jarum jam, maka itu adalah tipe l. (Aturan ini dikenal dalam bahasa Inggris dengan nama CORN, dari singkatan COOH - R - NH2).Pada umumnya, asam amino alami yang dihasilkan eukariota merupakan tipe l meskipun beberapa siput laut menghasilkan tipe d. Dinding sel bakteri banyak mengandung asam amino tipe d.
Polimerisasi asam amino
Lihat juga artikel tentang ekspresi genetik.Protein merupakan polimer yang tersusun dari asam amino sebagai monomernya. Monomer-monomer ini tersambung dengan ikatan peptida, yang mengikat gugus karboksil milik satu monomer dengan gugus amina milik monomer di sebelahnya. Reaksi penyambungan ini (disebut translasi) secara alami terjadi di sitoplasma dengan bantuan ribosom dan tRNA.
Pada polimerisasi asam amino, gugus -OH yang merupakan bagian gugus karboksil satu asam amino dan gugus -H yang merupakan bagian gugus amina asam amino lainnya akan terlepas dan membentuk air. Oleh sebab itu, reaksi ini termasuk dalam reaksi dehidrasi. Molekul asam amino yang telah melepaskan molekul air dikatakan disebut dalam bentuk residu asam amino.
Zwitter-ion
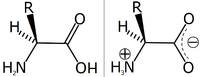
Asam amino dalam bentuk tidak terion (kiri) dan dalam bentuk zwitter-ion.
Asam amino dasar (standar)
Protein tersusun dari berbagai asam amino yang masing-masing dihubungkan dengan ikatan peptida. Meskipun demikian, pada awal pembentukannya protein hanya tersusun dari 20 asam amino yang dikenal sebagai asam amino dasar atau asam amino baku atau asam amino penyusun protein (proteinogenik). Asam-asam amino inilah yang disandi oleh DNA/RNA sebagai kode genetik.Berikut adalah ke-20 asam amino penyusun protein (singkatan dalam kurung menunjukkan singkatan tiga huruf dan satu huruf yang sering digunakan dalam kajian protein), dikelompokkan menurut sifat atau struktur kimiawinya:
Asam amino alifatik sederhana
- Glisina (Gly, G)
- Alanina (Ala, A)
- Valina (Val, V)
- Leusina (Leu, L)
- Isoleusina (Ile, I)
Asam amino hidroksi-alifatik
Asam amino dikarboksilat (asam)
- Asam aspartat (Asp, D)
- Asam glutamat (Glu, E)
Amida
- Asparagina (Asn, N)
- Glutamina (Gln, Q)
Asam amino basa
Asam amino dengan sulfur
uProlin
- Prolina (Pro, P) (memiliki gugus siklik)
Asam amino aromatik
- Fenilalanina (Phe, F)
- Tirosina (Tyr, Y)
- Triptofan (Trp, W)
Fungsi biologi asam amino
- Penyusun protein, termasuk enzim.
- Kerangka dasar sejumlah senyawa penting dalam metabolisme (terutama vitamin, hormon dan asam nukleat).
- Pengikat ion logam penting yang diperlukan dalam dalam reaksi enzimatik (kofaktor).
Asam amino esensial
Asam amino diperlukan oleh makhluk hidup sebagai penyusun protein atau sebagai kerangka molekul-molekul penting. Ia disebut esensial bagi suatu spesies organisme apabila spesies tersebut memerlukannya tetapi tidak mampu memproduksi sendiri atau selalu kekurangan asam amino yang bersangkutan. Untuk memenuhi kebutuhan ini, spesies itu harus memasoknya dari luar (lewat makanan). Istilah "asam amino esensial" berlaku hanya bagi organisme heterotrof.Bagi manusia, ada delapan (ada yang menyebut sembilan) asam amino esensial yang harus dipenuhi dari diet sehari-hari, yaitu isoleusina, leusina, lisina, metionina, fenilalanina, treonina, triptofan, dan valina. Histidina dan arginina disebut sebagai "setengah esensial" karena tubuh manusia dewasa sehat mampu memenuhi kebutuhannya. Asam amino karnitina juga bersifat "setengah esensial" dan sering diberikan untuk kepentingan pengobatan.
Campur aduk . xD
A. Fermentasi Asam Laktat
Fermentasi asam laktat yaitu fermentasi dimana hasil akhirnya adalah asam laktat. Peristiwa ini dapat terjadi di otot dalam kondisi anaerob.
Reaksinya: C6H12O6 ————> 2 C2H5OCOOH + Energi
 enzim
enzim
Prosesnya :
1. Glukosa ————> asam piruvat (proses Glikolisis).
 enzim
enzim
C6H12O6 ————> 2 C2H3OCOOH + Energi
2. Dehidrogenasi asam piravat akan terbentuk asam laktat.
 2 C2H3OCOOH + 2 NADH2 ————> 2 C2H5OCOOH + 2 NAD
2 C2H3OCOOH + 2 NADH2 ————> 2 C2H5OCOOH + 2 NAD
 piruvat
piruvat
 dehidrogenasa
dehidrogenasa
Energi yang terbentak dari glikolisis hingga terbentuk asam laktat :
8 ATP — 2 NADH2 = 8 - 2(3 ATP) = 2 ATP.
Fermentasi asam laktat yaitu fermentasi dimana hasil akhirnya adalah asam laktat. Peristiwa ini dapat terjadi di otot dalam kondisi anaerob.
Reaksinya: C6H12O6 ————> 2 C2H5OCOOH + Energi
Prosesnya :
1. Glukosa ————> asam piruvat (proses Glikolisis).
C6H12O6 ————> 2 C2H3OCOOH + Energi
2. Dehidrogenasi asam piravat akan terbentuk asam laktat.
Energi yang terbentak dari glikolisis hingga terbentuk asam laktat :
8 ATP — 2 NADH2 = 8 - 2(3 ATP) = 2 ATP.
B. Fermentasi Alkohol
Pada beberapa mikroba peristiwa pembebasan energi terlaksana karena asam piruvat diubah menjadi asam asetat + CO2 selanjutaya asam asetat diabah menjadi alkohol.
Dalam fermentasi alkohol, satu molekul glukosa hanya dapat menghasilkan 2 molekul ATP, bandingkan dengan respirasi aerob, satu molekul glukosa mampu menghasilkan 38 molekul ATP.
Reaksinya :
1. Gula (C6H12O6) ————> asam piruvat (glikolisis)
2. Dekarbeksilasi asam piruvat.
Asampiruvat ————————————————————> asetaldehid + CO2.
 piruvat dekarboksilase
piruvat dekarboksilase (CH3CHO)
(CH3CHO)
3. Asetaldehid oleh alkohol dihidrogenase diubah menjadi alkohol
 (etanol).
(etanol).
 2 CH3CHO + 2 NADH2 —————————————————> 2 C2HsOH + 2 NAD.
2 CH3CHO + 2 NADH2 —————————————————> 2 C2HsOH + 2 NAD.
 alkohol dehidrogenase
alkohol dehidrogenase
 enzim
enzim
Ringkasan reaksi :
C6H12O6 —————> 2 C2H5OH + 2 CO2 + 2 NADH2 + Energi
C. Fermentasi Asam Cuka
Fermentasi asam cuka merupakan suatu contoh fermentasi yang berlangsung dalam keadaan aerob. Fermentasi ini dilakukan oleh bakteri asam cuka (Acetobacter aceti) dengan substrat etanol.
Energi yang dihasilkan 5 kali lebih besar dari energi yang dihasilkan oleh fermentasi alkohol secara anaerob.
Reaksi:
 aerob
aerob
C6H12O6 —————> 2 C2H5OH ———————————————> 2 CH3COOH + H2O + 116 kal
 (glukosa)
(glukosa)  bakteri asam cuka
bakteri asam cuka  asam cuka
asam cuka
Pada beberapa mikroba peristiwa pembebasan energi terlaksana karena asam piruvat diubah menjadi asam asetat + CO2 selanjutaya asam asetat diabah menjadi alkohol.
Dalam fermentasi alkohol, satu molekul glukosa hanya dapat menghasilkan 2 molekul ATP, bandingkan dengan respirasi aerob, satu molekul glukosa mampu menghasilkan 38 molekul ATP.
Reaksinya :
1. Gula (C6H12O6) ————> asam piruvat (glikolisis)
2. Dekarbeksilasi asam piruvat.
Asampiruvat ————————————————————> asetaldehid + CO2.
3. Asetaldehid oleh alkohol dihidrogenase diubah menjadi alkohol
Ringkasan reaksi :
C6H12O6 —————> 2 C2H5OH + 2 CO2 + 2 NADH2 + Energi
C. Fermentasi Asam Cuka
Fermentasi asam cuka merupakan suatu contoh fermentasi yang berlangsung dalam keadaan aerob. Fermentasi ini dilakukan oleh bakteri asam cuka (Acetobacter aceti) dengan substrat etanol.
Energi yang dihasilkan 5 kali lebih besar dari energi yang dihasilkan oleh fermentasi alkohol secara anaerob.
Reaksi:
C6H12O6 —————> 2 C2H5OH ———————————————> 2 CH3COOH + H2O + 116 kal
Arti fotosintesis adalah proses penyusunan atau pembentukan dengan menggunakan energi cahaya atau foton. Sumber energi cahaya alami adalah matahari yang memiliki spektrum cahaya infra merah (tidak kelihatan), merah, jingga, kuning, hijau, biru, nila, ungu dan ultra ungu (tidak kelihatan).
Yang digunakan dalam proses fetosintesis adalah spektrum cahaya tampak, dari ungu sampai merah, infra merah dan ultra ungu tidak digunakan dalam fotosintesis.
Dalam fotosintesis, dihasilkan karbohidrat dan oksigen, oksigen sebagai hasil sampingan dari fotosintesis, volumenya dapat diukur, oleh sebab itu untuk mengetahui tingkat produksi fotosintesis adalah dengan mengatur volume oksigen yang dikeluarkan dari tubuh tumbuhan.
Untuk membuktikan bahwa dalam fotosintesis diperlukan energi cahaya matahari, dapat dilakukan percobaan Ingenhousz.
2. Pigmen Fotosintesis
Fotosintesis hanya berlangsung pada sel yang memiliki pigmen fotosintetik. Di dalam daun terdapat jaringan pagar dan jaringan bunga karang, pada keduanya mengandung kloroplast yang mengandung klorofil / pigmen hijau yang merupakan salah satu pigmen fotosintetik yang mampu menyerap energi cahaya matahari.
2. Pigmen Fotosintesis
Fotosintesis hanya berlangsung pada sel yang memiliki pigmen fotosintetik. Di dalam daun terdapat jaringan pagar dan jaringan bunga karang, pada keduanya mengandung kloroplast yang mengandung klorofil / pigmen hijau yang merupakan salah satu pigmen fotosintetik yang mampu menyerap energi cahaya matahari.
Dilihat dari strukturnya, kloroplas terdiri atas membran ganda yang melingkupi ruangan yang berisi cairan yang disebut stroma. Membran tersebut membentak suatu sistem membran tilakoid yang berwujud sebagai suatu bangunan yang disebut kantung tilakoid. Kantung-kantung tilakoid tersebut dapat berlapis-lapis dan membentak apa yang disebut grana Klorofil terdapat pada membran tilakoid dan pengubahan energi cahaya menjadi energi kimia berlangsung dalam tilakoid, sedang pembentukan glukosa sebagai produk akhir fotosintetis berlangsung di stroma.
Faktor-faktor yang berpengaruh terhadap pembentukan klorofil antara lain :
1. Gen :2. Cahaya :
3. Unsur N. Mg, Fe :
4. Air :
Pada tabun 1937 : Robin Hill mengemukakan bahwa cahaya matahari yang ditangkap oleh klorofil digunakan untak memecahkan air menjadi hidrogen dan oksigen. Peristiwa ini disebut fotolisis (reaksi terang).
H2 yang terlepas akan diikat oleh NADP dan terbentuklah NADPH2, sedang O2 tetap dalam keadaan bebas. Menurut Blackman (1905) akan terjadi penyusutan CO2 oleh H2 yang dibawa oleh NADP tanpa menggunakan cahaya. Peristiwa ini disebut reaksi gelap NADPH2 akan bereaksi dengan CO2 dalam bentuk H+ menjadi CH20.CO2 + 2 NADPH2 + O2 ————> 2 NADP + H2 + CO+ O + H2 + O2
Ringkasnya :
Reaksi terang :
Reaksi gelap :
atau
2 H2O + CO2 ——> CH2O + O2
atau
12 H2O + 6 CO2 ——> C6H12O6 + 6 O2
3. Kemosintesis
Tidak semua tumbuhan dapat melakukan asimilasi C menggunakan cahaya sebagai sumber energi. Beberapa macam bakteri yang tidak mempunyai klorofil dapat mengadakan asimilasi C dengan menggunakan energi yang berasal dan reaksi-reaksi kimia, misalnya bakteri sulfur, bakteri nitrat, bakteri nitrit, bakteri besi dan lain-lain. Bakteri-bakteri tersebut memperoleh energi dari hasil oksidasi senyawa-senyawa tertentu.
Bakteri besi memperoleh energi kimia dengan cara oksidasi Fe2+ (ferro) menjadi Fe3+ (ferri).
Bakteri Nitrosomonas dan Nitrosococcus memperoleh energi dengan cara mengoksidasi NH3, tepatnya Amonium Karbonat menjadi asam nitrit dengan reaksi:
 Nitrosomonas
Nitrosomonas
(NH4)2CO3 + 3 O2 ——————————> 2 HNO2 + CO2 + 3 H20 + Energi
 Nitrosococcus
Nitrosococcus
(NH4)2CO3 + 3 O2 ——————————> 2 HNO2 + CO2 + 3 H20 + Energi
1. Sintesis Lemak
Lemak dapat disintesis dari karbohidrat dan protein, karena dalam metabolisme, ketiga zat tersebut bertemu di dalarn daur Krebs. Sebagian besar pertemuannya berlangsung melalui pintu gerbang utama siklus (daur) Krebs, yaitu Asetil Ko-enzim A. Akibatnya ketiga macam senyawa tadi dapat saling mengisi sebagai bahan pembentuk semua zat tersebut. Lemak dapat dibentuk dari protein dan karbohidrat, karbohidrat dapat dibentuk dari lemak dan protein dan seterusnya.
Lemak dapat disintesis dari karbohidrat dan protein, karena dalam metabolisme, ketiga zat tersebut bertemu di dalarn daur Krebs. Sebagian besar pertemuannya berlangsung melalui pintu gerbang utama siklus (daur) Krebs, yaitu Asetil Ko-enzim A. Akibatnya ketiga macam senyawa tadi dapat saling mengisi sebagai bahan pembentuk semua zat tersebut. Lemak dapat dibentuk dari protein dan karbohidrat, karbohidrat dapat dibentuk dari lemak dan protein dan seterusnya.
4.1. Sintesis Lemak dari Karbohidrat :
 Glukosa diurai menjadi piruvat ———> gliserol.
Glukosa diurai menjadi piruvat ———> gliserol.
 Glukosa diubah ———> gula fosfat ———> asetilKo-A ———> asam lemak.
Glukosa diubah ———> gula fosfat ———> asetilKo-A ———> asam lemak.
 Gliserol + asam lemak ———> lemak.
Gliserol + asam lemak ———> lemak.
4.2. Sintesis Lemak dari Protein:Sebelum terbentuk lemak asam amino mengalami deaminasi lebih dabulu, setelah itu memasuki daur Krebs. Banyak jenis asam amino yang langsung ke asam piravat ———> Asetil Ko-A.
Asam amino Serin, Alanin, Valin, Leusin, Isoleusin dapat terurai menjadi Asam pirovat, selanjutnya asam piruvat ——> gliserol ——> fosfogliseroldehid Fosfogliseraldehid dengan asam lemak akan mengalami esterifkasi membentuk lemak.
Lemak berperan sebagai sumber tenaga (kalori) cadangan. Nilai kalorinya lebih tinggi daripada karbohidrat. 1 gram lemak menghasilkan 9,3 kalori, sedangkan 1 gram karbohidrat hanya menghasilkan 4,1 kalori saja.
5. Sintesis Protein
Sintesis protein yang berlangsung di dalam sel, melibatkan DNA, RNA dan Ribosom. Penggabungan molekul-molekul asam amino dalam jumlah besar akan membentuk molekul polipeptida. Pada dasarnya protein adalah suatu polipeptida.
Setiap sel dari organisme mampu untuk mensintesis protein-protein tertentu yang sesuai dengan keperluannya. Sintesis protein dalam sel dapat terjadi karena pada inti sel terdapat suatu zat (substansi) yang berperan penting sebagai "pengatur sintesis protein". Substansi-substansi tersebut adalah DNA dan RNA.
GENETIKA adalah ilmu yang mempelajari sifat-sifat keturunan (hereditas) serta segala seluk beluknya secara ilmiah.
Orang yang dianggap sebagai "Bapak Genetika" adalah JOHAN GREGOR MENDEL.
Orang yang pertama mempelajari sifat-sifat menurun yang diwariskan dari sel sperma adalah HAECKEL (1868).
Blendel mempelajari hereditas pada tanaman kacang ercis (Pisum sativum) dengan alasan:
1. Memiliki pasangan-pasangan sifat yang menyolok.
2. Biasanya melakukan penyerbukan sendiri (Self polination).
3. Dapat dengan mudah diadakan penyerbukan silang.
4. Segera menghasilkan keturunan.
GALUR MURNI adalah vanetas yang terdiri dari genotip yang homozigot. Simbol "F" (= Filium) menyatakan turunan, sedang simbol "P" (=Parentum) menyatakan induk.
HIBRIDA (BASTAR) adalah keturunan dari penyerbukan silang dengan sifat-sifat beda ——> jika satu sifat beda disebut MONOHIBRIDA, jika 2 sifat beda disebut DIHIBRIDA dst.
DOMINAN adalah sifat-sifat yang tampak (manifes) pada keturunan. RESESIF adalah sifat-sifat yang tidak muncul pada keturunan.
• Tiap sifat organisma hidup dikendalikan oleh sepasang "faktor
 keturunan". Pada waktu itu Mendel belummenggunakan istilah "gen".
keturunan". Pada waktu itu Mendel belummenggunakan istilah "gen".
• Tiap pasangan faktor keturunan menunjukkan bentuk alternatif
 sesamanya, kedua bentuk alternatif disebut pasangan ALELA.
sesamanya, kedua bentuk alternatif disebut pasangan ALELA.
• Satu dari pasangam alela itu dominan dan menutup alela yang resesif
 bila keduanya ada bersama-sama.
bila keduanya ada bersama-sama.
• Pada pembentukan "gamet" alela akan memisah, setiap gamet
 menerima satu faktor alela tersebut c dikenal sebagai HUKUM
menerima satu faktor alela tersebut c dikenal sebagai HUKUM
 PEMISAHAN MENDEL atau PRINSIP SEGREGASI SECARA BEBAS.
PEMISAHAN MENDEL atau PRINSIP SEGREGASI SECARA BEBAS.
• INDIVIDU MURNI mempunyai dua alela yang sama (homozigot), alel
 dominan diberi simbol huruf besar sedang alel resesif huruf keciL
dominan diberi simbol huruf besar sedang alel resesif huruf keciL
GENOTIP adalah komposisi faktor keturunan (tidak tampak secara fisik).
FENOTIP adalah sifat yang tampak pada keturunan.
Pada hibrida atau polihibrida berlaku PRINSIP BERPASANGAN SECARA BEBAS.
• Tiap pasangan faktor keturunan menunjukkan bentuk alternatif
• Satu dari pasangam alela itu dominan dan menutup alela yang resesif
• Pada pembentukan "gamet" alela akan memisah, setiap gamet
• INDIVIDU MURNI mempunyai dua alela yang sama (homozigot), alel
GENOTIP adalah komposisi faktor keturunan (tidak tampak secara fisik).
FENOTIP adalah sifat yang tampak pada keturunan.
Pada hibrida atau polihibrida berlaku PRINSIP BERPASANGAN SECARA BEBAS.
RATIO FENOTIP (F2) HIBRIDA NORMAL MENURUT MENDEL
| Monohibrida Dihibrida Trihibrida Polihibrida |
| (n) = jenis sifat berbeda (hibridanya). Intermediat 1 : 2 : 1 ——> sifat "SAMA DOMINAN"; percobaan pada bunga Antirrhinum majus. |
BACK CROSS ——> perkawinan antara F2 dengan salah satu indukaya.
TEST CROSS ———> perkawinan antara F2 dengan induk atau individu yang homozigot resesif
PENYIMPANGAN SEMU HUKUM MENDEL
Sebenarnya masih mengikuti hukum Mendel ———> alel berinteraksi.
Dikenal beberapa bentulc ———> Ratio fenotip F2)
TEST CROSS ———> perkawinan antara F2 dengan induk atau individu yang homozigot resesif
PENYIMPANGAN SEMU HUKUM MENDEL
Sebenarnya masih mengikuti hukum Mendel ———> alel berinteraksi.
Dikenal beberapa bentulc ———> Ratio fenotip F2)
| 1. INTERAKSI PASANGAN ALELA pada varitas ayam ——> 9 : 3 : 3 : 1 2. POLIMERI (Nielson-Echle) pada varitas gandum ——> 15 : 1 3. KRIPTOMERI pada tanaman "pukul empat" (Mirabilis jalapa) 4. EPISTASIS & HIPOSTASIS pada varitas gandum 5. KOEPISTASIS pada Lathyrusodoratus |
POLIMERI
adalah pembastaran heterozigot dengan banyak sifat beda yang berdiri sendiri-sendiri tetapi mempengaruhi bagian yang same dari suatu organisme.
KRIPTOMERI
adalah pembastaran heterozigot dengan adanya sifat yang "tersembunyi" (Kriptos) yang dipengaruhi oleh suatu keadaan, pada bunga Linaria maroccana adalah pH air sel !!
EPISTASIS
adalah faktor pembawa sifat yang menutup pemunculan sifat yang lain sekalipun sifat tersebut dominan
HIPOSTASIS
adalah faktor yang tertutupi oleh faktor lain.
ATAVlSME
adalah sifat yang hipostasis pada suatu keturunan yang pada suatu seat muncul kembali (reappearence).
adalah pembastaran heterozigot dengan banyak sifat beda yang berdiri sendiri-sendiri tetapi mempengaruhi bagian yang same dari suatu organisme.
KRIPTOMERI
adalah pembastaran heterozigot dengan adanya sifat yang "tersembunyi" (Kriptos) yang dipengaruhi oleh suatu keadaan, pada bunga Linaria maroccana adalah pH air sel !!
EPISTASIS
adalah faktor pembawa sifat yang menutup pemunculan sifat yang lain sekalipun sifat tersebut dominan
HIPOSTASIS
adalah faktor yang tertutupi oleh faktor lain.
ATAVlSME
adalah sifat yang hipostasis pada suatu keturunan yang pada suatu seat muncul kembali (reappearence).
KROMOSOM
adalah struktur benang dalam inti sel yang bertanggung jawab dalam hal sifat keturunan (hereditas). Kromosom adalah KHAS bagi makhluk hidup.
GEN adalah "substansi hereditas" yang terletak di dalam kromosom.
Gen bersifat antara lain :
- Sebagai materi tersendiri yang terdapat dalam kromosom.
- Mengandung informasi genetika.
- Dapat menduplikasikan diri pada peristiwa pembelahan sel.
adalah struktur benang dalam inti sel yang bertanggung jawab dalam hal sifat keturunan (hereditas). Kromosom adalah KHAS bagi makhluk hidup.
GEN adalah "substansi hereditas" yang terletak di dalam kromosom.
Gen bersifat antara lain :
- Sebagai materi tersendiri yang terdapat dalam kromosom.
- Mengandung informasi genetika.
- Dapat menduplikasikan diri pada peristiwa pembelahan sel.
Sepasang kromosom adalah "HOMOLOG" sesamanya, artinya mengandung lokus gen-gen yang bersesuaian yang disebut ALELA.
LOKUS adalah lokasi yang diperuntukkan bagi gen dalam kromosom.
ALEL GANDA (MULTIPLE ALLELES) adalah adanya lebih dari satu alel pada lokus yang sama.
LOKUS adalah lokasi yang diperuntukkan bagi gen dalam kromosom.
ALEL GANDA (MULTIPLE ALLELES) adalah adanya lebih dari satu alel pada lokus yang sama.

Dikenal dua macam kromosom yaitu:
1. Kromosom badan (Autosom).
2. Kromosom kelamin / kromosom seks (Gonosom).
THOMAS HUNT MORGAN
adalah ahli genetika dari Amerika Serikat yang menemukan bahwa faktor-faktor keturunan (gen) tersimpan dalam lokus yang khas dalam kromosom.
Percobaan untuk hal ini dilakukan pada lalat buah (Drosophila melanogaster) dengan alasan sebagai berikut:
- Cepat berkembang biak,
- Mudah diperoleh dan dipelihara,
- Cepat menjadi dewasa (umur 10 - 14 hari sudah de~wasa),
- Lalat betina bertelur banyak,
- Hanya memiliki 4 pasang kromosom, sehingga mudah diteliti.
1. Kromosom badan (Autosom).
2. Kromosom kelamin / kromosom seks (Gonosom).
THOMAS HUNT MORGAN
adalah ahli genetika dari Amerika Serikat yang menemukan bahwa faktor-faktor keturunan (gen) tersimpan dalam lokus yang khas dalam kromosom.
Percobaan untuk hal ini dilakukan pada lalat buah (Drosophila melanogaster) dengan alasan sebagai berikut:
- Cepat berkembang biak,
- Mudah diperoleh dan dipelihara,
- Cepat menjadi dewasa (umur 10 - 14 hari sudah de~wasa),
- Lalat betina bertelur banyak,
- Hanya memiliki 4 pasang kromosom, sehingga mudah diteliti.
Orang yang mula-mula mendalami hal pola-pola hereditas adalah W.S. SUTTON dari Amerika Serikat.
Menurut Sutton bila ada gen-gen yang mengendalikan dua sifat beda bertempat pada kromosom yang sama, gen-gen itu tak dapat memisalkan diri secara bebas lebih-lebih bila gen-gen itu berdekatan lokusnya, maka akan berkecenderungan untuk selalu memisah bersama-sama. Peristiwa ini disebut LINKAGE (PAUTAN).
Ada kalanya kromosom yang memisah tidak membawa seluruh gen yang dimiliki tetapi hanya sebagian saja yang terbawa sedangkan sisanya dipenuhi oleh kromosom pasangannya. Peristiwa ini disebut CROSSING-OVER(PINDAH SILANG).
Kejadian ini diteliti oleh Morgan
Langganan:
Postingan (Atom)










